
中药活性成分是创新药物的重要来源,发现其作用靶点对揭示中药理论的物质基础并诠释中药理论的现代科学内涵至关重要。
近日,大连医科大学马骁驰课题组在中药药效物质及其作用机制研究上取得重大进展,一个月内在PNAS(IF=11.205)和Signal Transduct Target Ther(IF=18.187)发表两篇中药作用靶点文章,研究思路值得借鉴。
PNAS: 苦参酮靶向sEH减轻帕金森病症状
苦参酮是中药苦参的主要活性成分,常用于治疗腹泻、细菌和真菌感染、湿疹和炎症相关疾病,其对帕金森病(PD)是否有疗效尚不清楚。
2022年3月1日,该团队在PNAS(IF=11.205)发表研究,发现中药苦参活性成分苦参酮在PD中发挥治疗效果并揭示其直接作用靶点及机制。

01 发现苦参酮治疗PD的作用
研究发现苦参提取物在MPTP诱导的小鼠PD模型中显示出减轻PD作用,进一步采用质谱分析苦参提取物处理20min后的小鼠大脑组织和血浆代谢物发现kushenols F、N、 S、flemiphilippinin D、sophoraflavanone G和kurarinone 6种分子显著改变。文献报道kurarinone是苦参提取物的主要组分,故选取kurarinone进行PD治疗作用评估(图1A),发现kurarinone改善MPTP引起的PD小鼠的步态障碍和神经毒性(图1B、C),增强MPTP诱导的PD小鼠的TH表达和神经递质水平(图1D),逆转MPTP诱导的神经炎症和小胶质细胞的激活(图1E)。
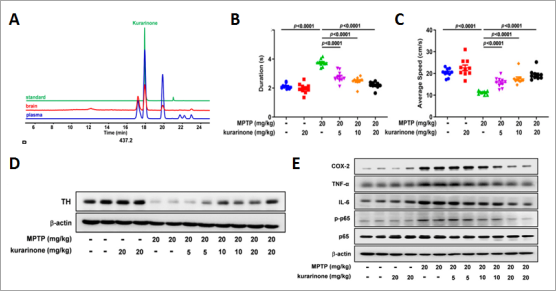
图1
02 筛选苦参酮的作用靶点
研究人员采用热蛋白质组分析(TPP,thermal proteome profiling)和溶剂诱导的蛋白质沉淀(SIP,solvent-induced proteinprecipitation)方法筛选kurarinone的潜在靶点(图2A)。对TPP和SIP共同鉴定到的3245种蛋白质进行了定量,包括sEH(基因名Ephx2)在内的14种蛋白质被确定为kurarinone的候选靶点(图2B、C),GO分析显示这些蛋白参与炎症反应在内的细胞过程。鉴于文献报道sEH在PD引起的神经炎症中发挥作用,研究人员采用Western blot进行了验证,发现随着温度和溶剂混合物百分比的升高,kurarinone处理组中的sEH逐渐降低,而对照组中的sEH 迅速下降,表明sEH是kurarinone的潜在靶蛋白(图2D)。
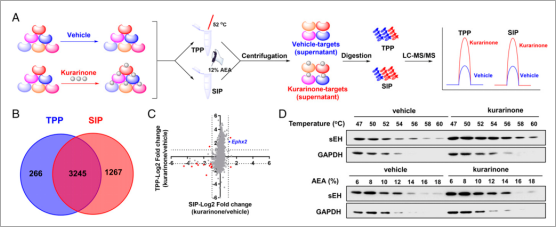
图2
随后,研究人员通过体外活性抑制实验发现kurarinone对sEH表现出剂量依赖性抑制作用(图3A),通过表面等离子共振 (SPR) 技术发现苦参酮能够以剂量依赖性方式增加其与sEH 的结合(图3B),通过共结晶证实kurarinone 分别与氨基酸残基 Tyr343、Ile363、Gln384 和 Asn472 和 OH-7、OH-20、OH-40 和 C-4 处的羰基形成四个常规的氢键相互作用(图3C)。
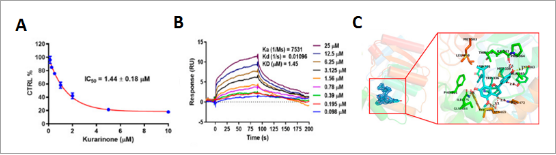
图3
03 苦参酮作用机制研究
sEH是一种α/β水解酶折叠蛋白,可水解EET以产生DHET,EETs及其相应DHETs是反映sEH活性的重要指标。研究人员随后通过质谱发现,kurarinone处理抑制MPTP介导的内源性EET的减少,并增加DHET水平(图4A),表明kurarinone抑制EH活性。GSK3β是一种重要的丝氨酸/苏氨酸激酶,参与神经炎症,且能被EET调控。研究人员发现MPTP诱导的PD小鼠中GSK3β 的磷酸化水平显著降低,而 kurarinone给药显着提高了其磷酸化水平(图4B)。这些结果表明,Kurarinone抑制sEH 活性以提高MPTP诱导的PD小鼠EET的内源性水平,从而稳定 GSK3β 磷酸化。最后,研究基因敲除鼠发现与MPTP治疗的WT组相比,Ephx2 KO小鼠显著减弱了MPTP诱导的步态障碍。施用kurarinone后,在MPTP处理的KO小鼠中未观察到其治疗效果(图4C),表明了kurarinone确实是通过Ephx2发挥作用的。
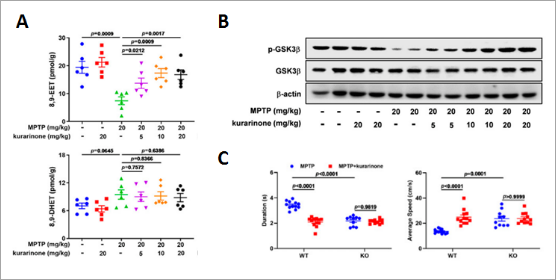
图4
STTT:紫草素靶向NEMO/IKKβ抑制结直肠癌进展
天然产物紫草素(SHK)是一种紫草的生物活性成分,具有多种生理和药理作用特性,包括抗炎、伤口愈合和抗癌症等。然而其对结肠癌的作用及背后的机制尚未被研究。
2022年3月9日,该团队在Signal Transduct Target Ther(IF=18.187)发表研究,发现中药紫草活性成分SHK在结直肠癌中发挥治疗效果并揭示其直接作用靶点及机制。

01 发现紫草素抑制结直肠癌进展
研究首先通过细胞实验和动物实验发现SHK(结构见图5A)能够抑制结直肠癌细胞增殖(图5B),抑制结直肠癌小鼠肿瘤生长(图5D),并抑制炎症因子分泌(图5C、E),表明SHK能够在体内和体外下调炎症信号通路进而抑制结直肠癌进展。
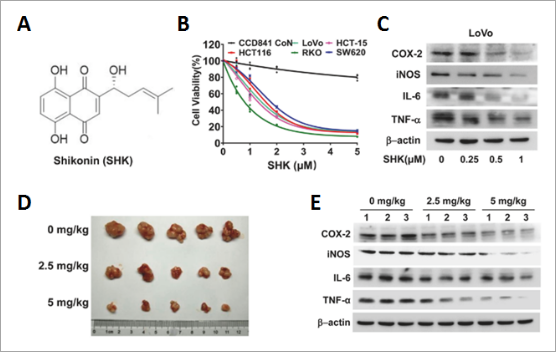
图5
02 筛选紫草素的作用靶点
研究人员采用TPP和SIP方法来揭示SHK的潜在靶点(图6A)。对TPP和SIP共同鉴定到的2269种蛋白质进行了定量,包括PRDX5、NEMO在内的22种蛋白质被确定为SHK的候选目标(图6B、6C),GO分析其中的PRDX5、NEMO参与炎症反应过程(图6D),IKKβ虽然没有被质谱打出,但已被报道能够与NEMO形成复合物调控NF-kB通路。于是研究人员通过Western blot进行了验证,发现随着温度和溶剂混合物百分比的升高,SHK处理加速了NEMO以及IKKβ蛋白对温度或溶剂变化的沉淀,表明NEMO、IKKβ是SHK的作用靶点(图6E、6F),而PRDX5也被质谱打到且与炎症相关,但WB实验发现SHK处理不能引起PRDX5下游NRF-2和HO1信号的改变,故将其排除。
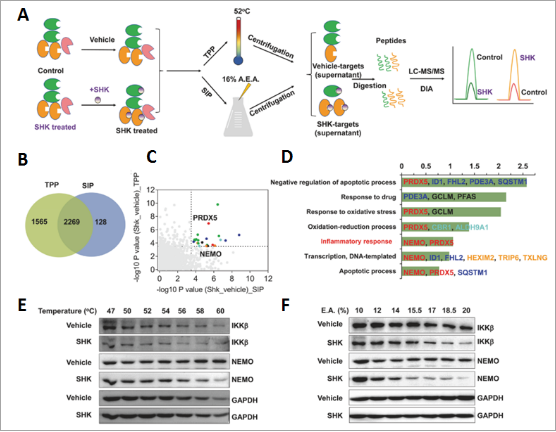
图6
03 紫草素的作用机制研究
NEMO/IKKΒ被报道是负责IκB磷酸化的亚基,随后释放游离的NF-κB二聚体(p50和p65亚基)进入细胞核以促进促炎基因的转录。研究人员发现SHK以剂量依赖性方式抑制IKKβ的磷酸化和激酶活性,降低p-IκB-α的蛋白质水平(图7A),SHK处理后也观察到对NF-κB荧光素酶活性的显著抑制(图7B、7C),减少p50/p65亚基向细胞核的易位(图7D、7E)。表明SHK破坏癌细胞中的 IKKβ-NEMO 相互作用抑制炎症通路。
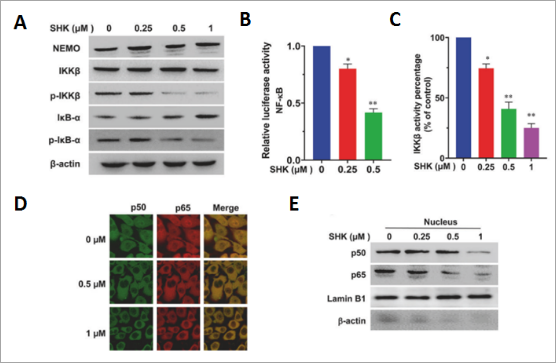
图7
04 验证紫草素与NEMO/IKKB的相互作用
研究人员最后通过co-IP(图8A)、Pull-down(图8B)、SPR(图8C)、体外活性抑制实验(图8D)、共结晶实验(图8E)、分子对接(图8F)分别验证了紫草素能够与NEMO/IKKΒ结合,并发现SHK与NEMO/IKKΒ复合物的重要结合域结合,包括D738(IKKβ)、M94和R101(NEMO)形成四个氢键,在相互作用界面外与Q98(NEMO)形成两个氢键,用丙氨酸替换D738、W739、W741 或M94/Q98/R101(三点共突变)阻止了NEMO/IKKβ复合物的形成。
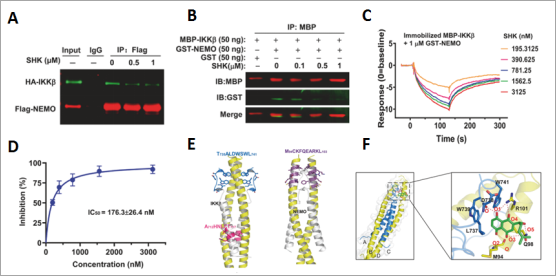
图8
总结与讨论
两篇文章采用了相似的研究思路和研究手段:
第一步,发现中药活性单体对改善疾病。通过细胞实验、动物实验发现中药活性单体改善疾病表型,并且影响疾病相关的生物学过程,如炎症反应等;
第二步,筛选中药活性单体的作用靶点。通过TPP和SIP方法揭示SHK的靶点并进行筛选和验证;(达吉特可提供其他筛选策略,如20K人类蛋白组芯片、Pulldown+质谱等)
第三步,研究靶点下游的表型相关通路。通过细胞实验、动物实验发现将靶点敲除以后药物不再发挥治疗作用,且疾病表型相关的信号通路如炎症通路发生改变。
第四步,挖掘中药活性单体与靶点的结合形式。通过co-IP、Pull-down、SPR、体外活性抑制实验、共结晶实验、分子对接等实验全面验证了中药活性单体与靶点的结合。
总之,该研究为我们开展中药小分子研究提供了一个值得借鉴的思路,其中找到中药活性单体的作用靶点并进行验证是两篇文章发表在高分杂志上的关键。
达吉特专注于药靶研究,可为您寻找药物靶点提供多种多样的专业的技术服务和解决方案,助您解决药物靶点-机理研究中的各种难题。
达吉特针对于中药及小分子药物研究,建立了一套完整的技术服务体系:
1)中药/复方的有效成分高精度鉴定;
2)中药有效成分与代谢物组织空间分布
3)小分子化合物批量标记(生物素/炔基/荧光)
4)小分子钓靶(标记法):20K人类蛋白组芯片/ ABPP
5)小分子钓靶(非标记法):DARTS /Lip-MS/ CETSA
6)膜蛋白靶点筛选技术:SPIDER / MPA/GPCR膜蛋白芯片
7)药物调控通路筛选:磷酸化抗体芯片/磷酸化蛋白组
8)SPR表面等离子共振(分子动力学)
9) 药-靶结合位点分析(高分辨质谱/分子对接)
10) PET-CT与药物分布小动物活体成像
11)天然产物化合物库筛选
丨相关产品
 | .jpg) |  |

.jpg)

