
三阴性乳腺癌 (TNBC) 是具有高度侵袭性且预后极差的乳腺癌亚型,化疗是其主要治疗方式,但由于其疗效有限且伴有一定程度的副作用,所以寻找更为安全有效的疗法刻不容缓。由此,众多科研人员致力于探索治疗三阴乳腺癌的潜在药物和新的治疗靶点。天然产物如今已成为新药发现的重要来源,众多天然产物展现出治疗三阴性乳腺癌的潜在效用,同时,靶点研究有助于进一步阐明其作用机制。
01 野马追内酯B(EB)靶向BCAT1介导的BCAA代谢,抑制SHOC2-RAS-ERK信号通路的激活,诱导三阴性乳腺癌细胞凋亡
近期,南方科技大学第一附属医院团队联合中国中医科学院王继刚教授团队发表了题为“Small-molecule targeting BCAT1-mediated BCAA metabolism inhibits the activation of SHOC2-RAS-ERK to induce apoptosis of Triple-negative breast cancer cells”的文章,揭示了来源于传统药用植物野马追的野马追内酯B(EB)通过靶向BCAT1介导的BCAA代谢抑制SHOC2/RAS/ERK激活,诱导三阴性乳腺癌细胞凋亡。

1、野马追内酯B在体内和体外均能有效抑制三阴乳腺癌进展
首先,研究者通过体外实验,发现小分子野马追内酯B(EB)对TNBC细胞具有显著的抑制作用(图1A-C)。随后,研究者构建了乳腺癌模型小鼠进一步探究EB在体内的抗肿瘤作用, 结果显示,EB治疗组的小鼠,肿瘤体积和重量明显减小,且对其他器官组织并无显著影响(图1D-E)。以上结果表明,EB对于TNBC具有良好的治疗潜力。
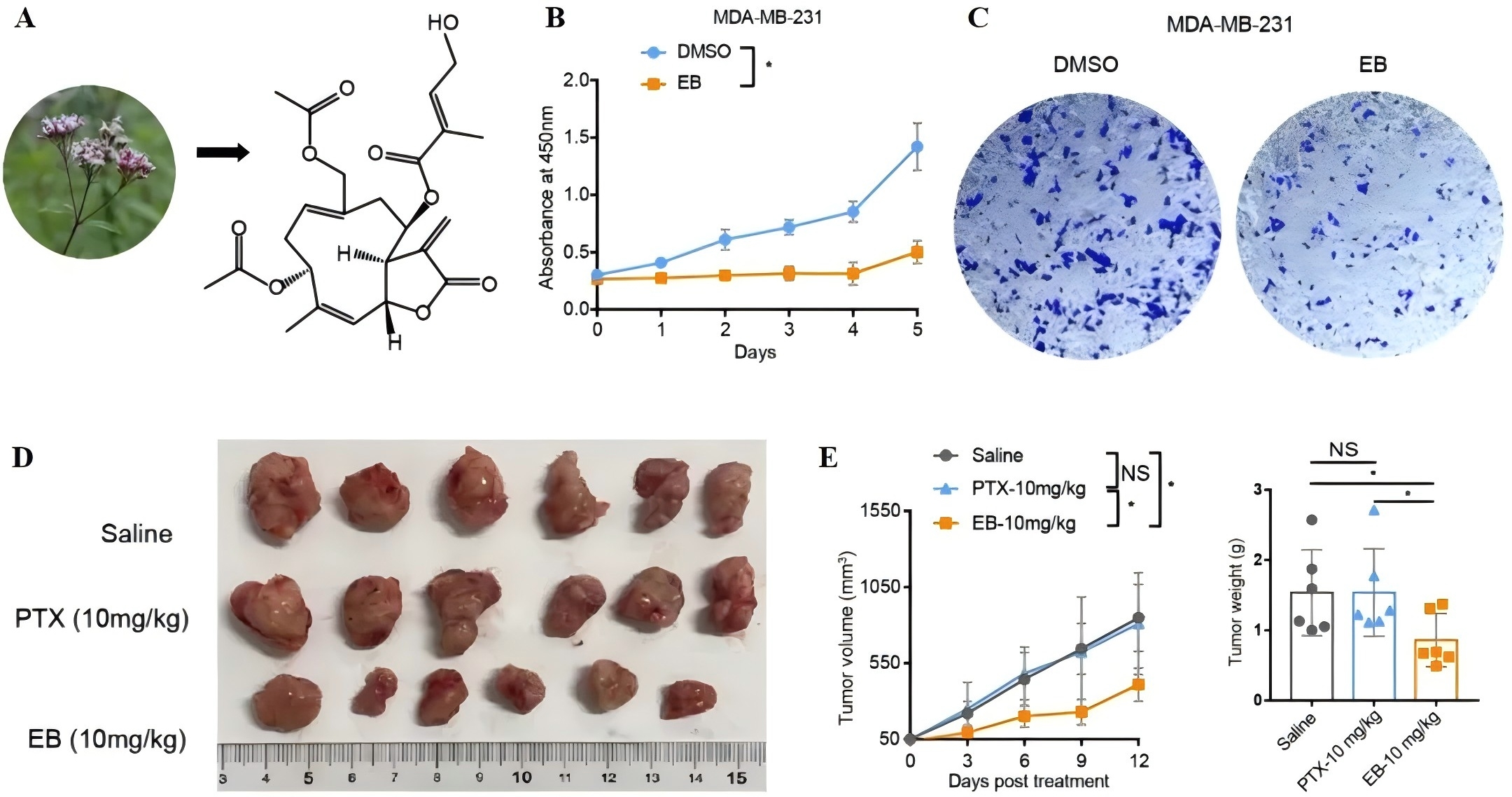
图1 野马追内酯B在体内和体外均能有效抑制三阴乳腺癌进展
2、BCAT1是野马追内酯B治疗三阴乳腺癌的直接靶点
为了探究EB治疗TNBC的作用机制,研究者利用炔基标记EB,合成了保留原有抗TNBC活性的小分子探针,并利用ABPP技术筛选EB在TNBC细胞中的直接靶点(图2A-C)。实验结果显示,支链氨基酸转移酶1(BCAT1)是EB的潜在靶点蛋白(图2D-E)。随后,研究者利用Pull down/CETSA+WB验证了EB与BCAT1的相互作用,且免疫荧光实验结果表明二者在TNBC细胞中的共定位(图2F-G)。此外,研究者通过质谱和分子对接确定了BCAT1的Cys335残基是EB的特异性结合位点。

图2 BCAT1是野马追内酯B治疗三阴乳腺癌的直接靶点
3、野马追内酯B通过靶向BCAT1介导的BCAA代谢,抑制SHOC2/RAS/ERK信号通路,诱导三阴乳腺癌细胞凋亡
最后,研究者通过蛋白组学分析、Western blot以及RT-qPCR等实验进一步探究EB靶向BCAT1抑制TNBC的药理机制,结果显示,BCAT1通过增强SHOC2蛋白的表达和下游RAS/ERK致癌信号通路的激活来促进肿瘤发生(图3A),而EB可以抑制BCAT1介导的与肿瘤发生发展关系密切的支链氨基酸(BCAA)代谢(图3B-C),并且EB处理和BCAT1敲低均可影响与细胞凋亡相关的基因的表达(图3D-E)。以上结果表明,EB通过靶向BCAT1,抑制其介导的BCAA代谢,下调SHOC2/RAS/ERK信号通路,促进TNBC细胞凋亡。此外,研究者发现EB与来自FDA批准的药物库中的化合物坎地沙坦进行联合治疗,能够显著增强TNBC细胞凋亡水平(图3F),为治疗TNBC提供了新的思路。
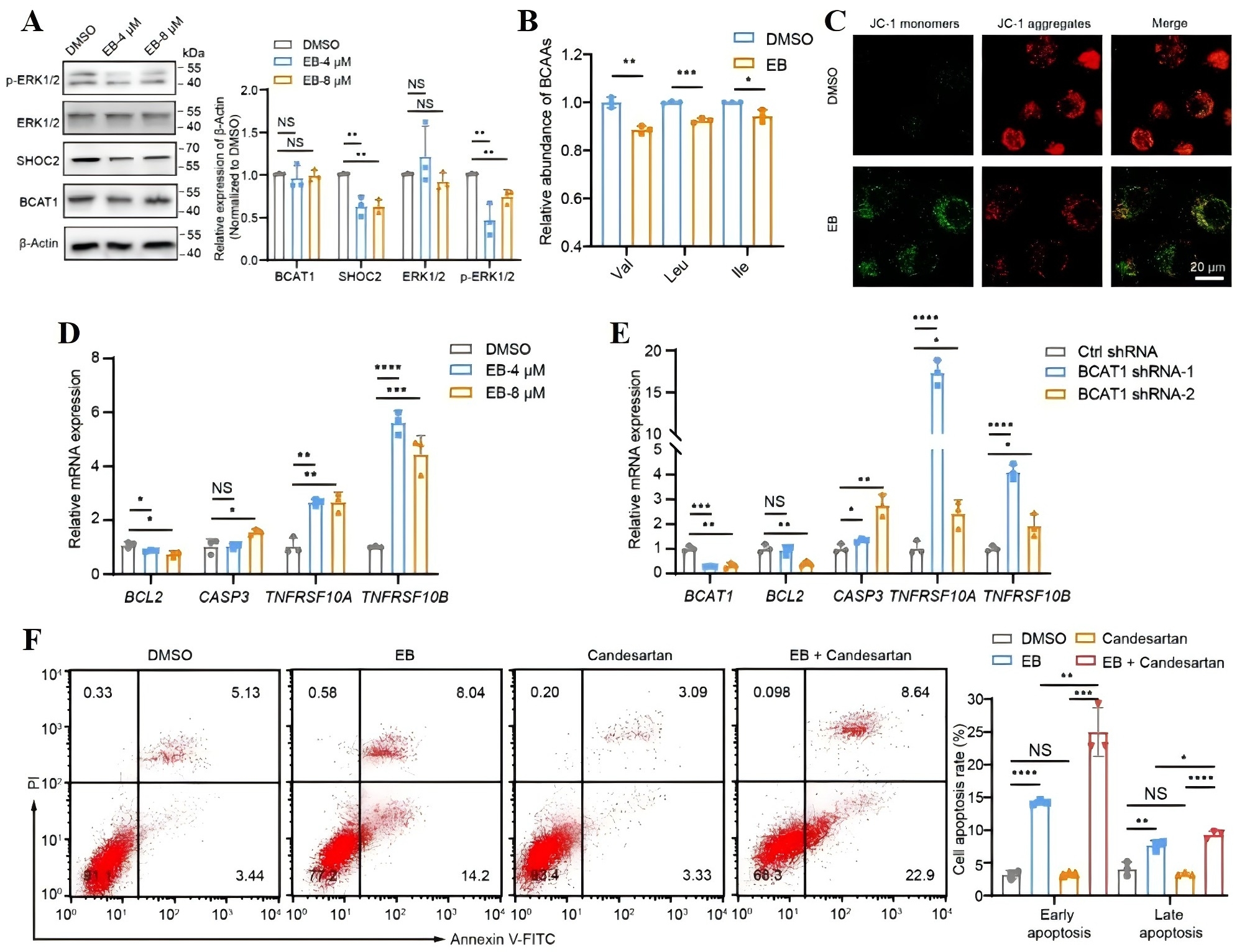
图3 野马追内酯B通过靶向BCAT1介导的BCAA代谢,抑制SHOC2/RAS/ERK信号通路,诱导三阴乳腺癌细胞凋亡
总之,本研究发现了天然产物小分子野马追内酯B能够显著抑制三阴乳腺癌进展,进一步的机制研究发现,野马追内酯B通过靶向BCAT1,抑制其介导的BCAA代谢,导致SHOC2蛋白合成减少,从而抑制RAS/ERK信号通路的激活,最终抑制癌细胞增殖并促进细胞凋亡。发现了三阴乳腺癌的治疗新靶标,为其临床新药开发提供了新的思路。

02 四氢姜黄素(THC)靶向TRIP13,抑制TRIP13/USP7/c-FLIP相互作用,介导c-FLIP 泛素化,促进三阴性乳腺癌外源性细胞凋亡
同期上线的另外一篇文章,天津中医药大学康宁教授团队发表的“Tetrahydrocurcumin targets TRIP13 inhibiting the interaction of TRIP13/USP7/c-FLIP to mediate c-FLIP ubiquitination in triple-negative breast cancer”,阐明了四氢姜黄素(THC)特异性靶向TRIP13,以抑制TRIP13/USP7/c-FLIP三聚体的形成,介导c-FLIP泛素化,最终诱导三阴乳腺癌外源性细胞凋亡。

1、四氢姜黄素通过抑制c-FLIP诱导癌细胞外源性凋亡,抑制三阴乳腺癌进展
研究者通过原位乳腺癌小鼠模型发现,THC能够显著抑制肿瘤进展(图1A-B)。与体内实验结果一致,THC以时间和剂量依赖性的方式在体外诱导癌细胞凋亡(图1C)。进一步的实验结果证实,THC通过抑制细胞凋亡过程中关键的负调控因子c-FLIP,从而诱导TNBC细胞凋亡的外源性途径(图1D)。Western blot和Co-IP等实验结果表明,THC通过泛素-蛋白酶体途径促进TNBC细胞中c-FLIP的降解,并增强c-FLIP的泛素化(图1E-F),从而诱导癌细胞外源性凋亡,抑制TNBC进展。
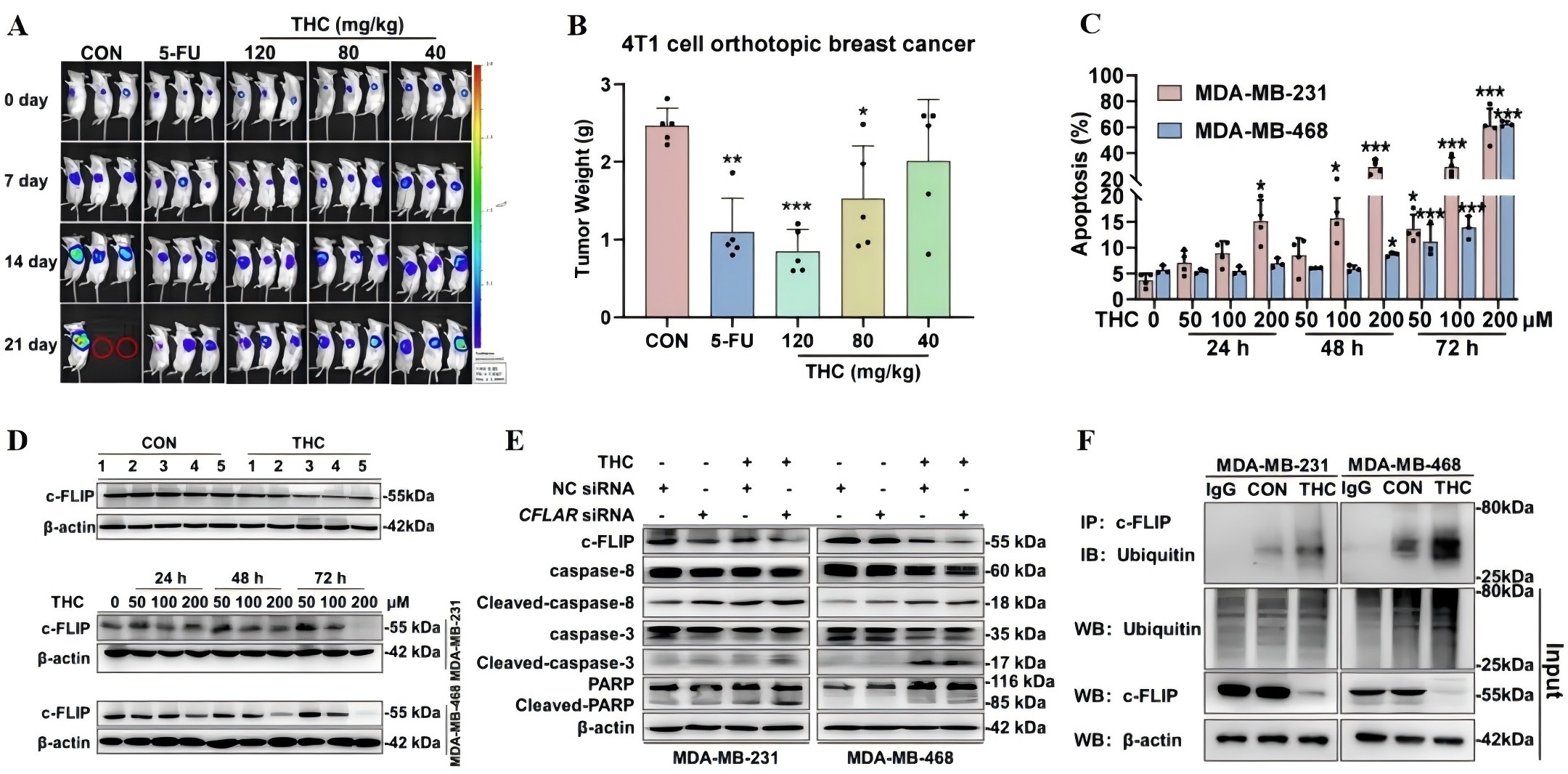
图1 四氢姜黄素通过抑制c-FLIP诱导癌细胞外源性凋亡,抑制三阴乳腺癌进展
2、四氢姜黄素通过靶向TRIP13,促进c-FLIP的泛素化,从而诱导三阴乳腺癌细胞的外源性凋亡
研究者设计并合成了THC小分子探针(图2A),确认了该探针仍具有抗TNBC细胞的活性后,利用ABPP技术筛选THC的靶点蛋白,LC-MS和TCGA数据库联合分析显示,TRIP13是THC的潜在作用靶标(图2B-C)。进一步的SPR以及CETSA/DARTS+WB实验证实了THC和TRIP13的直接结合(图2D-F)。此外,敲低TRIP13不仅增强了THC对c-FLIP表达的抑制,还促进了外源性凋亡途径的激活(图2G-H),表明THC通过靶向TRIP13,促进c-FLIP的泛素化,从而诱导TNBC的外源性凋亡。
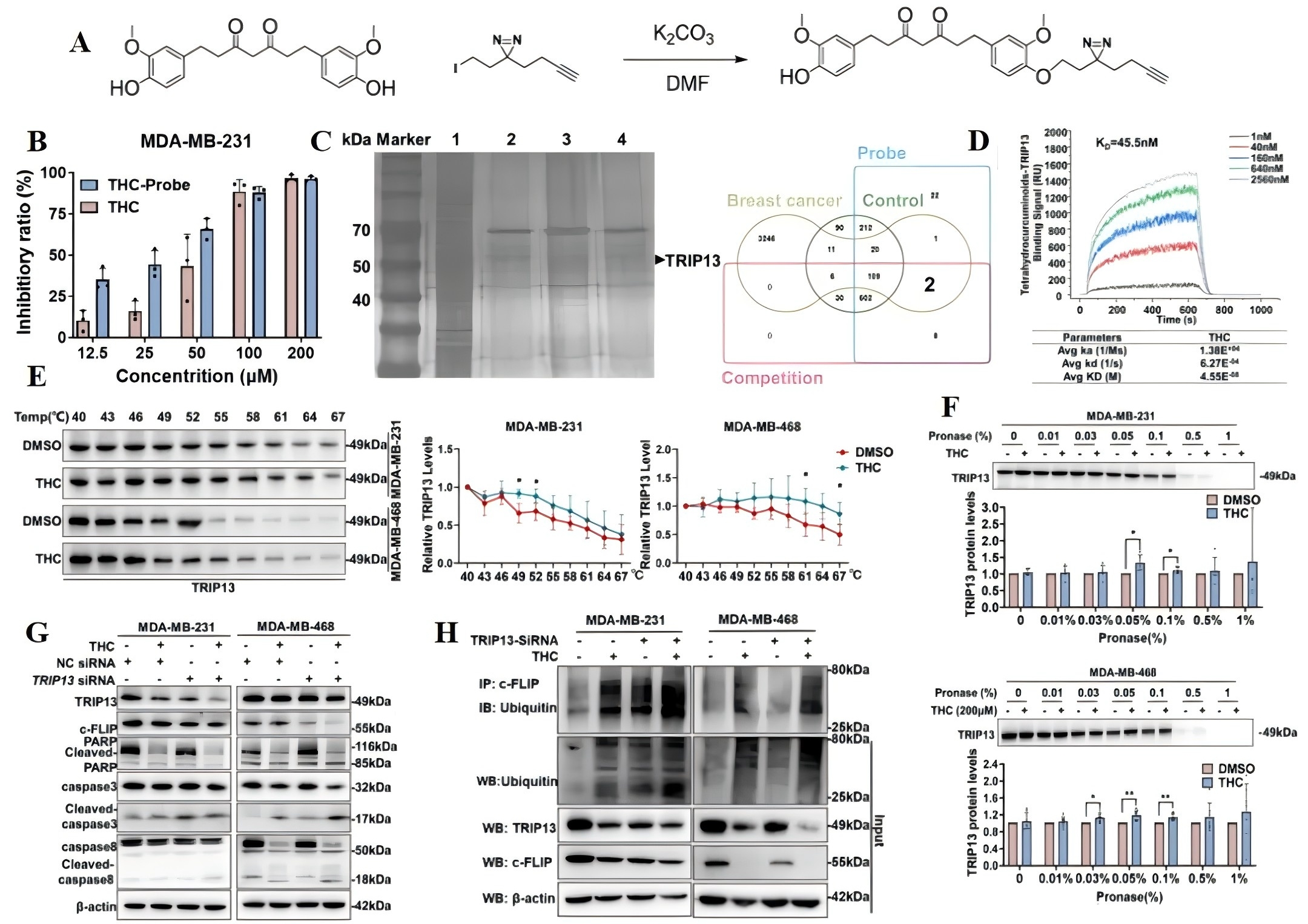
图2 四氢姜黄素通过靶向TRIP13,促进c-FLIP的泛素化,从而诱导三阴乳腺癌细胞的外源性凋亡
3、四氢姜黄素靶向TRIP13以抑制TRIP13/USP7/c-FLIP的相互作用,介导c-FLIP的泛素化,抑制三阴乳腺癌进展
最后,研究者探索了THC靶向TRIP13以抑制TNBC进展的深入机制,生信分析结果显示,TRIP13可能通过去泛素化酶USP7调节c-FLIP的水平(图3A)。Western blot结果显示TRIP13、USP7和c-FLIP在TNBC组织中高度表达,经THC处理后,体内和体外的USP7表达水平均显著降低(图3B)。研究者进一步探究了THC治疗后TRIP 13、c-FLIP和USP 7之间的相互作用,Co-IP、分子对接和免疫荧光实验结果显示,TRIP 13、USP 7和c-FLIP在TNBC中形成了三聚体(图3C-E)。体内实验进一步证实THC通过靶向TRIP13,以抑制TRIP 13/USP 7/c-FLIP的相互作用以介导c-FLIP泛素化(图3F),最终抑制TNBC进展。
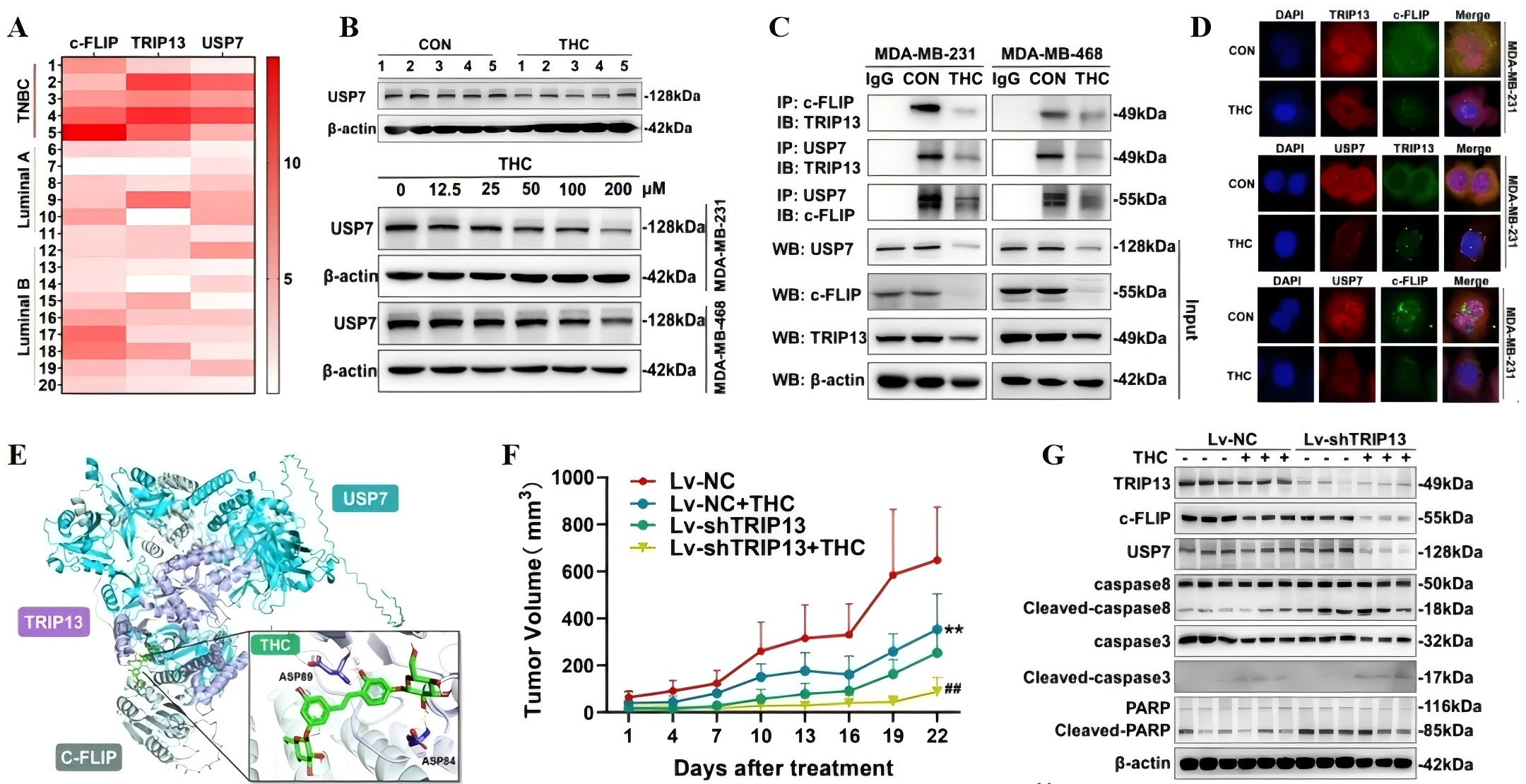
图3 四氢姜黄素靶向TRIP13以抑制TRIP13/USP7/c-FLIP的相互作用,介导c-FLIP的泛素化,抑制三阴乳腺癌进展
总之,本研究发现了天然产物四氢姜黄素(THC)能够特异性靶向TRIP13,破坏TRIP13/USP7/c-FLIP三聚体的形成,介导c-FLIP的泛素化,最终诱导三阴乳腺癌的外源性细胞凋亡。本研究发现了三阴乳腺癌的另一治疗靶点,同样为三阴乳腺癌的临床治疗奠定了良好的理论基础,提供了新的治疗策略。

总结与讨论
这两个研究充分表明,天然产物是新药开发领域的巨大宝库,越来越多的天然产物已被证实具有巨大的临床应用前景。而靶点研究更是药物开发的重中之重,药物直接靶点的筛选和验证也是机制研究中最关键一环。达吉特针对于药物的靶点筛选及验证,建立了一套完整的技术服务体系,可为您寻找药物靶点提供多种多样的专业技术服务和解决方案,助您解决药物靶点-机理研究中的各种难题。
中药物质基础研究及小分子药物靶点发现一直是达吉特专注的科学领域,我们希望达吉特能为越来越多的中药及复方走向全世界的过程中提供有价值的技术支持。
达吉特针对于中药及小分子药物研究,建立了一套完整的技术服务体系:
1)中药/复方的有效成分高精度鉴定;
2)中药有效成分与代谢物组织空间分布
3)小分子化合物批量标记(生物素/炔基/荧光)
4)小分子钓靶(标记法):20K人类蛋白组芯片/ ABPP
5)小分子钓靶(非标记法):DARTS /Lip-MS/ CETSA
6)膜蛋白靶点筛选技术:SPIDER / MPA
7)药物调控通路筛选:磷酸化抗体芯片/磷酸化蛋白组
8)SPR表面等离子共振(分子动力学)
9) 药-靶结合位点分析(高分辨质谱/分子对接)
10) PET-CT与药物分布小动物活体成像
11)天然产物化合物库筛选

.jpg)

